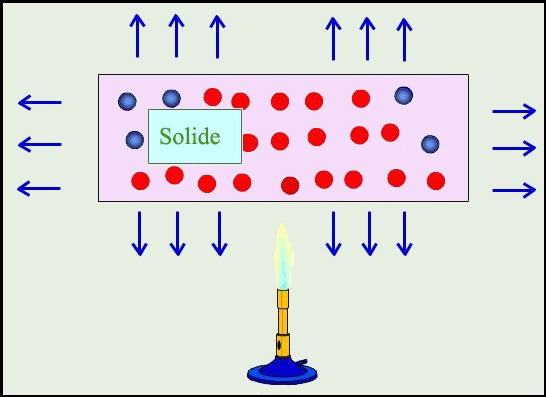
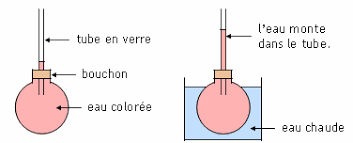
Vidéo : Interprétation d’un changement d’état d’un corps pur : ( 4 min 44 )
Rappels de 2nd: Les propriétés chimiques des atomes sont déterminées par leur configuration électronique, laquelle découle du nombre de protons de leur noyau. Ce nombre, appelé numéro atomique, définit un élément chimique.
Plusieurs atomes peuvent établir des liaisons chimiques entre eux grâce à leurs électrons. Ils peuvent, de façon générale, mettre chacun en commun un électron d'une de leurs couches externes afin de former un doublet d'électrons leur permettant de se lier entre eux. Cette liaison ainsi formée est une liaison dite covalente (il peut y avoir d’autres types de liaisons possibles). Les atomes liés entre eux forment alors des molécules.
Une autre façon pour les atomes de s’associer est de perdre ou de gagner un ou plusieurs électrons. Ils deviennent alors des ions qui lorsqu’ils ne sont pas en solution forment des solides par des liaisons électrostatiques.
Il existe plus d’une centaine d’éléments chimiques qui sont rangés dans un tableau : la classification périodique des éléments. Cette classification a pour particularité que tous les éléments d’une même colonne ont des propriétés chimiques semblables. Ces propriétés sont issues du fait que chaque élément d’une même colonne a le même nombre d’électrons sur leur dernière couche (on parle de même configuration électronique de valence).
Vidéo : La classification périodique des éléments : ( 5 min 07 )
Les deux premières colonnes représentent les métaux alcalins pour la première (sauf l’hydrogène qui est une particularité) et les métaux alcalino-terreux pour la deuxième.
Vidéo : Réactions entre les métaux et l’eau : ( 4 min 36 )
Vidéo : Les alcalins et l’eau : ( 1 min 53 )
L’avant dernière colonne représente les halogènes et la dernière les gaz rares ou gaz nobles dont la particularité est qu’ils sont inertes chimiquement car leur dernière couche électronique est saturée.